每日速递:揭示PPARγ缺陷介导HIV肠道屏障损伤新机制
标题:PPARγ缺陷致肠道屏障损伤
核心临床价值速递:
阐明肠道屏障损伤新机制:本研究系统揭示HIV感染者即使在ART治疗后,其肠道屏障持续破坏的核心机制在于结肠驻留CD8+ T细胞(TRM)的PPARγ表达下调,导致细胞自身脂质代谢紊乱。
发现非经典细胞毒作用:首次发现PPARγ缺陷的CD8+ T细胞通过接触依赖方式,从肠道上皮细胞膜“窃取”脂质,从而直接诱导上皮细胞凋亡,此过程不依赖于MHC-I或穿孔素/颗粒酶途径,是一种全新的致病机制。
验证潜在治疗靶点:使用PPARγ激动剂(如罗格列酮)可恢复CD8+ T细胞的脂质稳态,逆转上皮损伤。动物模型证实靶向此信号通路是修复屏障的有效策略,为治疗HIV相关肠道病变提供了新方向。
检测方案与临床落地应用:
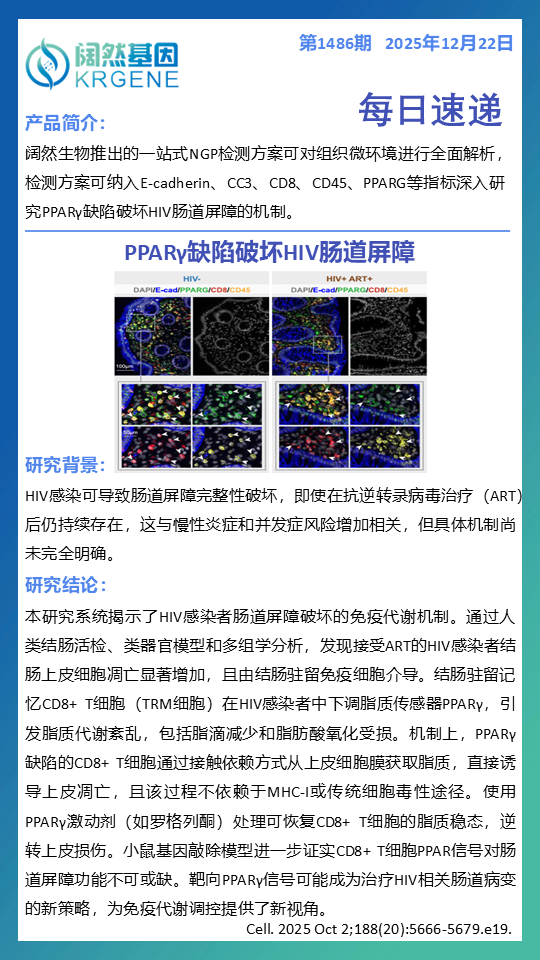
技术支撑:阔然生物一站式NGP检测方案,可利用多重荧光免疫组化(mIHC)等技术,对肠道等组织微环境中的E-cadherin(上皮标志)、CC3(凋亡标志)、CD8、CD45、PPARG等关键指标进行同步空间解析,精准验证上述机制。
核心应用:
机制可视化验证:在原位共定位分析PPARγ低表达的CD8+ T细胞与发生凋亡(CC3+)的肠道上皮细胞的空间毗邻关系。
屏障功能评估:量化上皮完整性标志物(如E-cadherin)的表达与分布变化,评估屏障损伤程度。
治疗响应监测:在临床前研究中,评估PPARγ激动剂干预后,上述细胞表型与空间互作关系的改善情况。
临床价值:
为理解HIV及其他慢性炎症性疾病相关的肠道黏膜损伤提供了全新的“免疫-代谢”视角和潜在治疗靶点(PPARγ信号)。
NGP检测方案可作为机制研究和靶向治疗开发的强有力工具,实现从表型到机制的深度挖掘。
行动建议:
对存在不明原因肠道屏障功能障碍的慢性炎症性疾病患者,可探索将其免疫细胞的PPARγ表达与功能作为新的研究维度。
推动PPARγ激动剂(如罗格列酮)用于治疗HIV相关肠道病变的临床前疗效验证与后续临床试验设计。
在相关研究中,采用空间多组学技术(如mIHC)深入解析免疫细胞与组织驻留细胞间的代谢互作。
一句话总结:研究揭示HIV感染者肠道CD8+ T细胞的PPARγ缺陷通过引发脂质代谢紊乱与非细胞毒性作用损伤上皮屏障,靶向该通路有望成为治疗新策略。
十大滚球体育app
Shanghai KR Pharmtech, Co., Ltd.