每日速递:靶向NNMT重塑卵巢癌免疫抑制微环境
标题:靶向CAFs代谢酶NNMT逆转免疫抑制
核心临床价值速递:
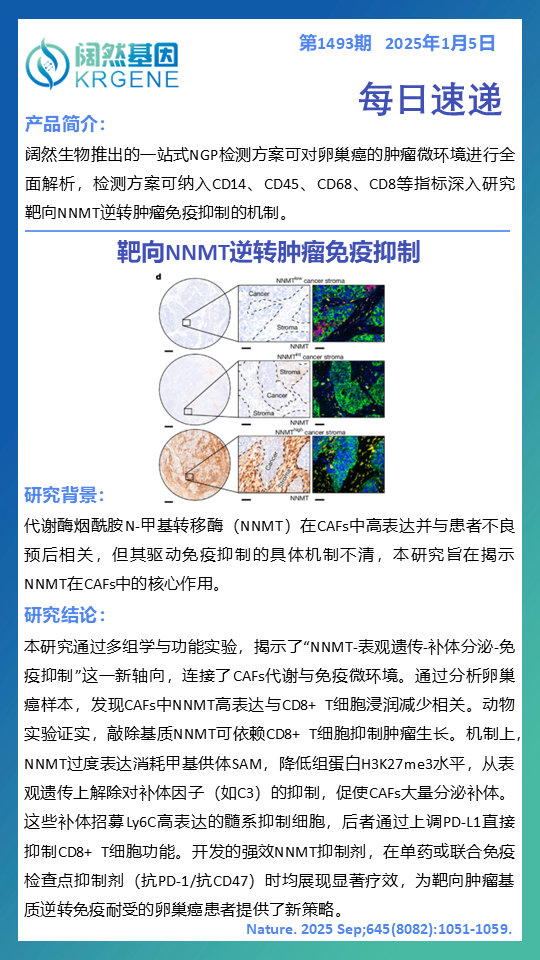
揭示CAFs驱动免疫抑制新轴心:研究首次在卵巢癌中阐明“NNMT-表观遗传-补体分泌-免疫抑制”的全新作用轴。癌症相关成纤维细胞(CAFs)通过高表达代谢酶NNMT,消耗甲基供体SAM,导致组蛋白H3K27me3水平降低,进而表观遗传性促进补体因子(如C3)分泌。
明确免疫抑制级联反应:CAFs异常分泌的补体可招募Ly6C+髓系抑制细胞,后者通过上调PD-L1直接抑制CD8+ T细胞功能,从而在肿瘤微环境内形成完整的免疫抑制环路。
验证全新治疗靶点:动物模型证实,敲除基质NNMT可显著抑制肿瘤生长,且此效应依赖于CD8+ T细胞。研究开发的强效NNMT抑制剂,无论是单药还是与抗PD-1/抗CD47联合,均显示出显著抗肿瘤效果。
检测方案与临床落地应用:
技术支撑:阔然生物一站式NGP检测方案,可利用多重荧光免疫组化(mIHC)等技术,对卵巢癌肿瘤微环境进行全景解析,通过纳入CD8、CD68、CD14、CD45等指标,精准量化关键免疫细胞亚群的变化。
核心应用:
机制表型验证:在治疗前后组织中,验证NNMT抑制剂对CAFs表型、补体沉积、髓系抑制细胞浸润及CD8+ T细胞功能活化的影响。
疗效预测与分层:评估患者CAFs中NNMT的表达水平,或补体激活/髓系细胞富集程度,为NNMT抑制剂或联合免疫治疗的适用人群提供生物标志物参考。
联合治疗评估:在临床前模型中,系统评估NNMT抑制剂与免疫检查点抑制剂联合治疗的协同效应及微环境重塑情况。
临床价值:
为克服卵巢癌免疫抑制微环境提供了全新的靶向基质代谢的治疗策略。
NGP检测方案可作为伴随诊断工具,用于筛选可能从NNMT靶向治疗中获益的患者,并动态监测治疗响应。
行动建议:
在卵巢癌患者,尤其是免疫“冷”肿瘤或耐药患者中,开展CAFs NNMT表达的检测,评估其作为治疗靶点的潜力。
积极推动NNMT抑制剂单药及与PD-1/L1抑制剂等联合疗法的临床转化研究。
利用空间多组学技术,进一步探索NNMT调控的补体信号及其他潜在下游效应,挖掘更多联合靶点。
一句话总结:本研究阐明了CAFs中NNMT通过表观遗传调控补体分泌、招募抑制性髓系细胞进而抑制CD8+ T细胞的完整轴心,为靶向肿瘤基质代谢逆转免疫抑制提供了全新策略。
十大滚球体育app
Shanghai KR Pharmtech, Co., Ltd.