每日速递:新生儿脑病治疗新靶点
每日速递:新生儿脑病治疗新靶点 标题:突破HIE治疗瓶颈!发现关键神经保护型星形胶质细胞亚群,阔然生物NGP检测助力精准评估与靶向修复 核心临床价值速递 1.发现全新治疗靶点与干预窗口 •首次鉴定出Dio2⁺Slc1a2⁺星形胶质细胞为关键的神经保护亚群,其核心功能是清除毒性谷氨酸、维持甲状腺激素T3稳态。该亚群在缺氧缺血性脑损伤(HIBD)后显著耗竭且无代偿性增加,这直接解释了神经功能无法自行修复的原因,并将Dio2-T3轴确立为极具潜力的药物干预新靶点。 2.突破传统认知,指明精准修复方向 •研究突破了将星形胶质细胞简单分为“好/坏”两类的传统观点,揭示了其在代谢、转运、增殖等多方面功能广泛受损。这提示未来的神经保护策略需从“泛保护”转向“精准修复”,特别是针对这一特定亚群的补充或功能支持。 3.为改善长期预后提供根本策略 •针对此靶点的治疗,旨在从病理早期修复脑内微环境稳态,有望从根本上减少神经元继发性损伤,从而降低患儿脑瘫、智力障碍等神经发育后遗症的长期风险,意义重大。 产品简介与临床落地应用(阔然生物) 阔然生物一站式NGP检测方案(涵盖Dio2、Slc1a2、Pcna、Fabp7、DAPI等指标)可实现: •精准病理评估:精准定量Dio2⁺Slc1a2⁺保护性星形胶质细胞的耗竭程度,为损伤严重程度提供客观、新型的生物标志物。 •功能状态解析:同步评估星形胶质细胞的增殖活性(Pcna)与代谢状态(Fabp7),全面揭示细胞功能损伤维度。 •转化研究与临床决策支持: •疗效预测:评估患儿内源性修复细胞的基线水平,预测预后及对潜在靶向治疗(如T3类似物、Dio2激动剂)的响应可能性。 •临床试验分层:为未来针对Dio2-T3轴的新型神经保护药物临床试验,提供精准的患者入组筛选和疗效评估的生物标志物工具。 临床行动建议 1.诊断与评估升级: •在条件允许的转化研究或精准医疗项目中,可对HIE患儿脑组织样本(如罕见病理样本)应用NGP检测,进行深度分子病理分型,超越传统形态学评估。 2.治疗策略新思路 •关注机制研究:鼓励并关注针对“Dio2-T3轴”和“谷氨酸清除”机制的神经保护药物研发。 •探索联合疗法:未来可探索将亚低温治疗与靶向星形胶质细胞修复的神经激素或细胞疗法相结合的联合策略,实现“神经保护”与“微环境修复”双管齐下。 3.研究方向: •探索外周血或脑脊液中能否找到替代性生物标志物,以无创方式反映脑内该亚群功能状态。 •研究如何通过药物、生物因子或细胞移植等手段,外源性补充或激活内源性Dio2⁺Slc1a2⁺星形胶质细胞。 一句话总结:研究发现了HIE后耗竭的关键神经保护型星形胶质细胞亚群(Dio2⁺Slc1a2⁺),将其确立为逆转神经损伤的新靶点;阔然生物NGP检测可为该靶向治疗策略的实现提供不可或缺的精准评估工具。 十大滚球体育app Shanghai KR Pharmtech, Co., Ltd.
【阔然开朗】下一代病理,阔然生物的中枢神经系统肿瘤微环境整体解决方案
中枢神经系统(CNS)肿瘤包含多种肿瘤类型及其相关亚型,部分肿瘤具有相当高的死亡率和发病率。传统的CNS肿瘤诊断主要基于组织学特征以及与假定的起源细胞类型的相似性。近些年来,随着下一代病理技术和分子生物学的发展,越来越多的研究发现,肿瘤免疫微环境已成为中枢神经系统肿瘤的一个重要方面,可能影响其恶性程度、预后和对治疗的反应。 目前,肿瘤微环境研究所用到的分析方法大多拘泥于单独的免疫组化方法,不能同时识别多个标志物,更难以准确分析肿瘤细胞和间质的异质性与演进规律,对于直接影响疗效的肿瘤微环境缺乏诊断方案。 随着蛋白质组学和多重蛋白原位标记测定技术推向应用,以多重荧光免疫组化(mIHC)技术为代表的下一代病理(NGP)技术能够一次检测多个目标靶点,并通过靶点组合和位置关系的研究,实现更准确、更全面、更高效地评估肿瘤免疫微环境,为肿瘤的诊断和免疫治疗提供了可靠依据。 在业内,下一代病理又被称为继NGS之后,病理科的下一个增量窗口。基于当前下一代病理还处于发展早期,行业对于下一代病理技术及产业的认识还不够深,本文将对下一代病理的产业链生态进行详细解析,期望为行业提供参考。 近年来在脑肿瘤研究领域中应用多重荧光免疫组化技术(mIHC)阐述肿瘤微环境的也逐年增长。2023年发表文章汇总如下: 胶质母细胞瘤(GBM)是侵袭性和致死性的脑肿瘤,尽管有手术切除、放疗和化疗等联合治疗策略,但患者结局较差。GBM患者对免疫治疗不敏感,患者预后较差,中位总生存期(OS)约为21个月。 案例1:新靶标的发现可预测PD-1阻断治疗的患者生存期 在胶质母细胞瘤复发(rGBM)的患者队列中,ERK1/2磷酸化(p-ERK)的免疫组织化学可以预测PD-1阻断后的总生存率,接受PD-1阻断治疗的高p-ERK肿瘤患者表现出更长的生存期。空间距离分析发现,与低p-ERK相比,TMEM119+细胞在高p-ERK肿瘤中更接近SOX2+p-ERK+细胞、CD163+细胞与SOX2+p-ERK+或GFAP+p-ERK+细胞之间的距离更短。 研究结果表明,p-ERK1/2指示rGBM患者对PD-1阻断的反应,rGBM患者拥有由表达MHC II的髓系/小胶质细胞组成的独特肿瘤免疫微环境。这为GBM提供了一个应用个性化方法的免疫治疗的机会,为一部分患者提供治疗益处,同时避免对其他人进行无效治疗。 案例2:单细胞转录组学联合mIHC分析肺腺癌脑转移的肿瘤微环境差异通过肺腺癌的原发肿瘤和脑转移的scRNA、免疫组织化学和免疫荧光揭示原发和转移肿瘤之间巨噬细胞和T细胞的差异,结果显示脑转移上皮细胞(BMAECs,表面生物标志物S100A9)与转移和预后有很强的相关性,结合医院已有样本进一步评估了脑转移指数的临床意义,确定了包括拉帕替尼在内的7种药物通过靶向BMAEC可能抑制LUAD脑转移。本研究分析了scRNA-seq数据,以表征易转移的LUAD病变的免疫微环境。还发现了一个细胞亚群BMAECs及其潜在的生物标志物S100A9,本研究为脑转移高危患者的早期发现和指导潜在治疗提供了见解,并预测了可能对高转移倾向患者有效的治疗药物,为今后进一步开展相关临床研究奠定了基础。 案例3:AAV-LIGHT法可促进胶质瘤的抗肿瘤免疫该研究使用脑内皮细胞靶向腺相关病毒(AAV)载体在小鼠GBM的脉管系统中表达LIGHT(AAV-LIGHT)。使用七色多重荧光免疫组化技术(Panel组成:CD8、CD4、CD19、TCF1、CD11c、CD31、Nuclei)分析发现在AAV-LIGHT组中,TLS和肿瘤内均存在TCF1+ CD8+ T细胞,而且更常聚集到与CD11c+ DC(抗原呈递)密切相互作用的微环境中,并定位于类似HEV的CD31+血管附近。该研究表明,通过靶向表达LIGHT来改变血管表型可以促进有效的抗肿瘤T细胞反应并延长胶质瘤的生存期,是一种有希望的GBMs治疗选择,包括那些对检查点阻断无反应的GBMs,这些发现对其他免疫治疗耐药癌症的治疗具有更广泛的意义。2023年4月,由北京市希思科临床肿瘤学研究基金会、良医汇和研值圈联合主办的“第三届肿瘤黑科技年会”,阔然生物凭借下一代病理技术(NGP)荣获“最受关注的肿瘤黑科技奖”。该项目基于多重荧光免疫组化技术,开发了成人胶质瘤分子分型AI判断系统,通过检测与胶质瘤分型及预后相关的6个重要指标,从单细胞水平的量化结果实现更细亚群的分层,更精准地评估胶质瘤患者的预后。通过更加精准、全面的预后评估,对于患者个性化用药诊疗、随访及疾病控制等方面具有重要的临床价值。 下一代病理技术已日趋完善, 产业化命题亟待解答 病理诊断在精准医学中扮演着非常重要的角色,面对不断精细的临床诊断需求,病理检查能够为手术、随访、用药、化疗的临床决策提供关键信息。但长期以来,由于流程繁琐,自动化程度较低,病理医生缺乏等原因,我国的病理学建设程度较低。 随着精准医疗的持续推进,民众生活水平不断提高,人们对于各类型疾病筛查的病理诊断需求逐年上升,病理诊断供需矛盾突出。 在此背景下,以多重荧光免疫组化(mIHC)技术为核心的下一代病理逐渐受到关注。 mIHC是一种用于同时检测多个标记物的技术,其显著优势在于,一是可以同时评估多个生物标志物:mIHC可以在同一组织切片上同时检测多个生物标志物,提供更全面的信息;二是高灵敏度和特异性,荧光信号可以在低浓度下被检测到,并且具有较低的背景信号,提供高灵敏度和特异性;三是空间分析:mIHC可以提供细胞和组织中不同标志物的空间分布信息,有助于了解细胞亚群的相互作用和组织结构;四是定量分析:通过数字图像分析,可以对mIHC的结果进行定量分析,提供更准确和客观的数据;最后是多通道成像:mIHC可以使用多个荧光通道同时检测多个标志物,提供更多的信息。 基于上述优势,mIHC在临床中具有广泛的应用潜力,可以用于诊断、预后评估和指导治疗等方面,包括肿瘤免疫治疗预测、肿瘤亚型鉴定、临床试验和伴随诊断测试、疾病诊断和分型、药物研发和药物靶点鉴定等。 随着病理学的自动化和数字化的增加,mIHC也将为病理学家提供有价值且多功能的研究工具。推进下一代病理技术的发展和广泛应用,不仅可以有效提升病理诊断的效率及准确性、节省诊断时间及运营成本,赋能病理科发展,还能让病理诊断跨越地域限制,解决病理医生缺口这一核心痛点。 目前,以多重荧光免疫组化技术为代表的下一代病理技术已经取得了一定进展,无论是在仪器的稳定性,还是试剂的可及性方面都已日趋完善。国内已有企业通过引进多重荧光免疫组化技术,为产业链下游提供科研服务和药企服务。 但不可否认的是,下一代病理的产业化仍处于早期阶段,还面临着临床认识度不深,产业链发展不成熟,上下游还未打通等问题,限制了技术的广泛应用和产业成熟发展。 当前的竞争核心在于,如何在构建下一代病理核心技术壁垒的基础之上,打通上下游产业链关键环节,推动技术的广泛应用和产业化。这也是下一代病理产业参与各方亟需解答的重要命题。 打通产业链上下游, 一体化解决方案战略价值凸显 随着下一代病理产业持续发展,NGP企业依据自身优势,通过跨界合作或是自主能力延伸,搭建全产业链服务平台已成为一大发展趋势。 下一代病理产业链的上游主要包括病理诊断仪器设备、试剂原料及数据软件等供应链厂商。产业链中游为阔然生物这类的科技创新型企业,作为行业的中坚力量,为产业链下游的各级医院/医疗机构、药企、科研机构以及第三方医学检验实验室等提供成熟产品和NGP一体化解决方案。 作为全球首批推动NGP技术产业化落地的企业之一,阔然生物于2019年便在国内开展多重荧光免疫组化技术的临床转化研究,并率先打通了多重荧光免疫组化技术上中下游产业链,以肿瘤免疫微环境检测的整体解决方案,实现了NGP产业化落地。 一方面,延伸至产业链上游,阔然生物积极推动仪器、软件以及抗体荧光染料等关键原料的注册申报工作,在降低多重荧光免疫组化技术成本的同时提高企业技术壁垒。 据了解,目前阔然生物已取得三色、四色、五色、六色、七色、八色、九色多标荧光显色试剂盒及其他免疫组化抗体试剂盒等20项备案和生产许可,并取得了Krast全自动免疫组化染色机的备案和生产许可,KR-HT5全自动荧光病理切片扫描系统也即将全面上市,标志着阔然生物的下一代病理一体化解决方案形成完整闭环。 在产业链中游,阔然生物整合Kreep多色荧光染色试剂盒、Krast全自动染色机、KR-HT5高通量荧光病理切片扫描仪、KRIAS医学病理影像分析系统,形成了针对肿瘤微环境全方位分析的整体解决方案。 此外,阔然生物还联合了中国头部病理中心、科研机构,形成产业联盟,推动技术的标准化体系打造和产业化进程。 面向产业链下游,阔然生物的肿瘤微环境全方位分析整体解决方案,可为医院病理科、第三方检验实验室以及药企提供科研服务、临床诊断服务和药企服务。 该方案集染色、成像、分析于一体,同时提供专业的数据挖掘与分析,通过对细胞表型、数量和活性进行定量评估,以及对细胞间的空间位置关系研究,为肿瘤免疫微环境研究、肿瘤治疗和预后评估提供了高效的工具,在临床应用中具有巨大的可行性和价值。 开放式平台战略,开启下一代病理黄金时代 基于医疗信息化发展趋势,医院病理科亟需开展数字病理科室转型,将病理数据转化为优质医疗资源,推动医疗创新。 然而,我国医疗机构的数字病理建设渗透率目前仍处于中低水平,产业发展和建设进度不匹配。其背后原因在于数字病理发展仍然面临一系列挑战,比如软硬件适配业务流程能力不足、数字病理科室建设成本高、营收体系尚不清晰、病理技术尚不能满足临床诊断需求、行业标准不统一等等。 从这一角度来看,阔然生物以多重荧光免疫组化为核心技术壁垒,集合仪器设备、试剂、软件和服务的肿瘤微环境检测整体解决方案,不仅能够帮助科室提高肿瘤精准诊疗水平,还能实现患者诊疗数据互联互通,保障系统和数据的兼容性、集成性和患者完整报告辅助诊断功能,有利于推动数字病理科室整体能力构建和转型。 当前,下一代病理正处于从科研向应用转化的关键阶段,阔然生物的最终目标就是加速推动该技术在临床实现大规模应用,推动下一代病理成为继NGS之后,病理科的下一个增长点。 阔然生物的肿瘤微环境分析整体解决方案,一方面为病理诊断带来全新的想象空间,另一方面也是为下一代病理产业化发展提供了标准和范例。为了推动NGP技术快速实现产业化、规模化发展,阔然生物采取开放平台战略,将多重荧光免疫技术平台开放给第三方医学检验实验室、科研机构、药厂等合作伙伴,形成行业合作联盟,共同探索多重荧光免疫技术在药物疗效预测、肿瘤复发风险评估、药物研发等场景的应用,打造技术-应用生态圈,形成行业共识,推动多重荧光免疫技术在临床落地。围绕中枢神经系统肿瘤可以利用前期单细胞转录组、空间转录组等多组学技术结合多重荧光免疫组化技术在定量、原位等方面的优势进一步深入探索肿瘤微环境中细胞的异质性以及变化,以期为更精准的诊断、预后评估、治疗提供新方向。参考资料:《中国智慧病理行业白皮书:商业化初露锋芒,直击病理AI的破与立》——动脉网《2022中国智慧数字病理行业发展白皮书》——上海市数字医学创新中心联系电话: 13681665165 13524812118 阔然生物是业内领先的肿瘤精准医疗高科技企业,业务范围覆盖第三方临床检测服务、医疗设备和试剂研发生产销售。拥有总面积达9200平方米的检测研发中心、5000平方米的IVD生产智造中心和占地50余亩的前港智慧医疗产业园,以现代分子病理诊断技术、大数据和人工智能算法为核心,构建可持续发展的疾病精准医疗生态圈,拥有百余项授权发明专利和软件著作权为核心的自主知识产权体系,已完成疾病全周期精准诊疗一体化方案和医疗器械智造为一体的产业布局。公司已获得高新技术企业、专精特新“小巨人”企业、临床基因扩增实验室、科技型中小企业、创新型中小企业等多项认证,建立了完善的质量管理体系,零缺陷通过美国病理家学会CAP认证,连续多年百余次满分通过国家临检中心、CAP等权威机构组织的室间质评,始终秉承“践行精准医疗”的使命,推动我国医疗事业发展。 声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、AiBrain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。 投稿邮箱:[email protected] 未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。
【阔然开朗】IDH1 突变抑制剂 DS-1001 在复发性或进展性 IDH1 突变神经胶质瘤患者中的首次人体 I 期研究
胶质瘤是颅内最常见的恶性肿瘤,目前主要治疗方案是放疗和化疗,但是疗效有限,特别是在高级别胶质瘤中。这也进一步表明探索胶质瘤新的治疗方案的重要性。IDH基因是目前药物研究热点,IDH 抑制剂包括 ivosidenib(AG-120)、vorasidenib(AG -881)、olutasidenib (FT-2102)、BAY1436032等都处于临床试验中。目前正在针对神经胶质瘤患者的临床试验中进行评估。在临床前研究中,DS-1001 已被证明可以抑制突变 IDH1,从而降低 D-2-HG 水平和肿瘤大小。本研究评估IDH抑制剂 DS-1001 药物对复发/进行性 IDH1 突变胶质瘤患者疗效和药效分析。 共入组47名患者(少突胶质细胞瘤 WHO 2级:少突胶质细胞瘤 WHO 3级:星形细胞瘤WHO 2级:星形细胞瘤WHO 3级:星形细胞瘤WHO 4级=4:11:12:11:7),35例患者肿瘤增强,30个(85.7%)接受了强化肿瘤治疗。12例患者肿瘤未增强,8个(66.7%)接受了非强化肿瘤治疗。 47例患者均可进行疗效评估。在35个增强组肿瘤患者中,观察到2个患者出现完全缓解,4名患者出现部分缓解。在12个非增强组肿瘤中:1名患者出现部分缓解,3名患者出现轻微缓解。增强组ORR为17.1%,非增强组ORR达到33.3%。35例增强组肿瘤患者中有15例(42.9%)出现了肿瘤缩小,12例非增强组肿瘤患者中有11例(91.7%)的肿瘤发生肿瘤缩小。其中2例完全缓解的增强型肿瘤患者中。星形细胞瘤患者(IDH突变;WHO 4级)在经历了约174周的完全缓解,目前仍在治疗中。另一位IDH1突变型间变性少突胶质瘤患者在约95周中处于完全缓解,目前仍在治疗中。3例增强组肿瘤患者出现明显的肿瘤缩小,接近完全缓解。在10名治疗响应患者中5人目前继续接受治疗。 在数据截止时,有8名患者(17.0%)仍在接受治疗。增强组胶质瘤患者的治疗中位数持续时间为7.3周,有3名患者(8.6%)继续接受治疗。在非增强组胶质瘤患者中,治疗时间中位数为91.2周,12名患者中有5人(41.7%)仍在接受治疗。增强组胶质瘤组的中位数PFS为10.4周,而非增强组神经胶质瘤组则未达到。 为了评估药物透过血脑屏障以及抑制肿瘤组织中 D-2-HG表达情况,对再次接受手术的疾病进展患者进行了一项探索性研究:评估患者肿瘤组织中DS-1001和D-2-HG的浓度。结果表明在所有切除的肿瘤样本中均检测到高浓度DS-1001药物,表明该药物的脑部渗透效率很高。与第一次手术样本相比,治疗中肿瘤组织中的 D-2-HG 水平极低,表明在DS-1001药物治疗后患者的D-2-HG的含量降低。 DS-1001 药物具有良好的耐受性和良好的脑渗透,复发/进行性 IDH1 突变胶质瘤患者对DS-1001治疗有疗效反应。一项 DS-1001 在未经化疗和放疗的 IDH1 突变 WHO 2 级神经胶质瘤患者中的研究正在进行中 (NCT04458272)。 声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、AiBrain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。 投稿邮箱:[email protected] 未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。
【阔然开朗】p16 蛋白表达缺失是高级别脑膜瘤中CDKN2A基因纯合缺失标志物
脑膜瘤是颅内最常见的良性肿瘤,其中WHO I级脑膜瘤占80%。现在关于脑膜瘤基因组分析研究发现与传统的肿瘤细胞形态学评估相比,分子标志物可以更好地预测患者的预后。研究表明无论组织学级别,携带CDKN2A纯合缺失或TERT启动子突变的脑膜瘤患者的临床预后与组织学诊断为间变性脑膜瘤(CNS WHO 3 级)的患者相似。因此,2021 年 WHO 中枢神经系统肿瘤分类中对间变性脑膜瘤的诊断特征包括TERT启动子突变或CDKN2A纯合缺失。但对于脑膜瘤的分子标志物检测平台暂时没有相关推荐。研究发现在脑膜瘤中存在 p16 蛋白表达缺失,但与CDKN2A基因之间的相关性暂时没有报道。 为了探索p16蛋白和CDKN2A基因之间的相关性,入组了 39 个高级别的脑膜瘤患者:非典型(2级,n=27,69%)、间变性(3级,n=12,31%)。利用DNA NGS测序分析CDKN2A基因的突变和拷贝数变异,利用免疫组化检测p16蛋白的表达。 DNA NGS结果显示7个脑膜瘤患者存在CDKN2A纯合缺失。免疫组化显示肿瘤细胞中p16蛋白表达缺失,在非肿瘤内皮细胞和炎症细胞中p16具有完整的染色。一个脑膜瘤患者(病例 #43)NGS结果显示CDKN2A 基因发生p.A60fs 失活截短突变,免疫组化显示肿瘤细胞中p16蛋白表达缺失。在31名NGS结果显示CDKN2A没有发生突变脑膜瘤中,28名患者免疫组化提示p16蛋白表达,但存在3名患者(病例 #5、#6和 #7,形态学均为2级)免疫组化结果显示p16表达缺失。 结果显示在高级别脑膜瘤中CDKN2A基因纯合缺失与p16缺失的总体敏感性为100%(8/8),特异性为 90%(28/31),阴性预测值为100% (28/28),阳性预测值为 73%(8/11)。 除了高级别脑膜瘤外,还对14 名低级别脑膜瘤(CNS WHO 1 级)进行了 p16 蛋白和CDKN2A基因之间对比,14名患者 DNA NGS测序显示CDKN2A基因没有发生变异。64%(9/14)的脑膜瘤患者出现p16蛋白缺失,这表明在低级别脑膜瘤中CDKN2A基因变异和p16蛋白缺失之间相关性较差。 结果表明免疫组化检测p16蛋白表达可以作为组织学诊断高级别脑膜瘤的CDKN2A基因变异的前期筛查,p16蛋白表达缺失可以进行进一步的分子检测确认CDKN2A基因突变或缺失。 引用文献:Tang V, Lu R, Mirchia K, Van Ziffle J, Devine P, Lee J, Phillips JJ, Perry A, Raleigh DR, Lucas CG, Solomon DA. Loss of p16 expression is a sensitive marker of CDKN2A homozygous deletion in malignant meningiomas. Acta Neuropathol.
【阔然开朗】分子病理下脑膜瘤的治疗
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、AiBrain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。 投稿邮箱:[email protected] 未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。
【阔然开朗】DNA甲基化图谱分类中少突胶质肉瘤亚型可能包括IDH野生型胶质瘤
少突胶质肉瘤是一类特殊的少突胶质细胞瘤,需要结合肉瘤组织学特征、IDH突变、TERT启动子突变或1p/19q发生共缺失这3个特征综合诊断,在一些无法进行明确诊断的案例中建议使用DNA甲基化图谱进行诊断。 本文介绍一例罕见的复发性 IDH野生型的成人胶质瘤,患者在1988年出现右侧额叶病变,进行粒子植入术治疗,后进行手术切除肿瘤组织,病理诊断为弥漫性星形细胞瘤;2021年7月出现复发,进行手术切除,组织学病理显示肉瘤样特征、栅栏状坏死区域、微血管增生和丰富的核分裂;免疫组化结果显示Olig2和GFAP阴性,MAP2C和YAP1表达阳性,H3K27me3表达弱阳性,IDH1(p.R132H)表达阳性、ATRX表达阳性。NGS测序结果显示TERT启动子突变、TP53无义突变、CIC突变,多个染色体出现拷贝数变异;RNA测序结果显示未发现基因融合。未发现与IDH野生型的胶质肉瘤/胶质母细胞瘤相关的典型基因突变,如EGFR、MET、PDGFRA等。DNA甲基化图谱结果显示IDH突变型的少突胶质肉瘤(脑肿瘤分类 12.5版)。 目前对于少突胶质肉瘤相关的报道较少,大部分报道的案例显示可能是原发性少突胶质细胞瘤复发导致,分子特征是IDH发生突变,1p/19q可能出现共缺失。本案例无法回溯1988年组织样本中的IDH变异情况,复发样本显示IDH野生型、多个染色体发生拷贝数变异,如7号染色体扩增、10号染色体缺失、CDKN2A/B纯合缺失,这些特征多出现在胶质肉瘤/胶质母细胞瘤中,但文献报道放疗复发的胶质肉瘤/胶质母细胞瘤大多没有TERT启动子突变和Chr7+/10-的分子特征。有文章报道原发性胶质瘤在放疗后会出现IDH突变“丢失”,这种丢失是由于突变等位基因缺失,本案例中的2号染色体(IDH1基因所处染色体)和15号染色体(IDH2基因所处染色体)的缺失可能是IDH野生型的原因。 本文报道了一名罕见复发胶质瘤患者,NGS测序结果显示IDH野生型但出现胶质肉瘤/胶质母细胞瘤中常见拷贝数变异如Chr7+/10-、CDKN2A纯合缺失。但DNA甲基化测序诊断为少突胶质肉瘤 IDH突变型。这为少突胶质肉瘤的诊断提供新证据。 参考文献Ebrahimi A, Herrlinger U, Waha A, Kaluza L, Pietsch T. Methylation class oligosarcoma may encompass IDH-wildtype gliomas. Acta Neuropathol. 2023 Mar;145(3):361-364. doi: 10.1007/s00401-022-02529-x. Epub 2022 Dec 15. PMID: 36520193; PMCID: PMC9925539. “十大滚球体育app(Shanghai KR Pharmtech, Inc. , Ltd.)”简称“阔然基因”,成立于2015年,总部位于上海,专注于精准医学转化研究与应用,致力于提供多应用场景的一站式分子诊断解决方案。旗下拥有三家高新技术企业、两家专精特新小巨人企业,拥有上海和徐州双研发中心、四家医学检验实验室(“零缺陷”通过CAP权威认证)、精准医学科技研究院、长三角国家创新中心联合创新中心、IVD生产工厂和占地50余亩的前港智慧医疗产业园。公司凭借“服务+产品”双重模式开展肿瘤分子诊断、肿瘤免疫微环境检测等业务,首创NGP(下一代病理)+NGS(下一代测序)的临床新应用服务,注重分子诊断试剂产品研发、注册、生产和销售,国内唯一开启NGP平台二类医疗器械(KR-HT5)的申报,拥有9款IVD产品注册申报储备(其中3款IVD产品于2022年获批欧盟CE认证),服务中国500余家医院和科研机构,建立了庞大的基因组数据库,秉承“践行精准医疗”的使命,推动我国医疗事业发展。 阔然基因脑胶质瘤分子诊断系列产品(CaptioX-G)是一款以NGS技术为基础的检测产品。CaptioX-G产品的开发主要以2016年WHO中枢神经系统肿瘤分类、胶质瘤诊疗规范(2018年版)、NCCN指南和cIMPACT-NOW update 1-7为依据,其涉及脑胶质瘤的分子分型(IDH、1p/19q、ATRX、TERTp)、化疗药物(MGMT)和潜在靶向药物相关的基因(MET、FGFR、NTRK、BRAF等)。CaptioX-G系列产品还能对1p/19q和7/10号染色体拷贝数变异进行检测,辅助IDH野生型的较低级别星型胶质细胞瘤和IDH突变型的星形胶质细胞瘤的再分类。CaptioX-G系列产品包括成人脑胶质瘤分子分型(CaptioX-G1)、儿童脑胶质瘤分子分型(CaptioX-pG1)、脑胶质瘤分型用药(CaptioX-G2)等产品,能满足广大脑胶质路患者分子诊断需求。
脑膜瘤基因检测助力脑膜瘤患者临床诊疗
脑膜瘤是中枢神经系统常见的肿瘤,根据组织形态将脑膜瘤分为15种亚型。基于组织学的脑膜瘤分级系统难以精准预测肿瘤的生物学行为,为诊治带来一定的挑战。此外,一些脑膜瘤与颅内间叶性肿瘤形态类似,且缺乏特异性诊断标记物,鉴别诊断困难。第5版WHO中枢神经系统肿瘤分类首次将分子特征纳入脑膜瘤分类,使脑膜瘤的诊断、分型及分级更加精确。今天,宁波市临床病理诊断中心葛荣主任医师分享一例诊断和分级困难的脑膜瘤病例,通过阔然基因脑膜瘤分子分型检测和融合基因检测项目对患者检测,辅助患者病理诊断,并进一步为临床治疗提供决策。 病例概况 患者,男,41岁。一月前无明显诱因出现头痛,查头颅MRI提示右侧桥小脑角区占位,脑膜瘤考虑(图1)。行后颅窝肿瘤切除,术后送检组织灰白灰褐色一堆,大小4.5×4.5×0.6cm。组织学:瘤细胞形态一致,卵圆形,间质黏液变(图2)。免疫组化:Vimentin(+++)、EMA(小灶+)、PR(-)、Ki-67(+)5%、P53(-)、GFAP(-)、NSE(-)、Olig2(-)、CgA(-)、Syn(-)、S-100(-)、CD31(-)。病理诊断:(后颅窝肿瘤)脑膜瘤,WHO 1级。术后患者按照WHO 1级脑膜瘤随访。 右侧桥小脑角区可见团块状稍长T1稍长T2信号影,DWI未见明显受限,周围可见脑组织水肿,范围约37mm*22mm*34mm,界尚清,增强呈明显均匀强化,可见脑膜尾征,相应骨质增厚,相应小脑及脑干受压,第四脑室受压。 两年后,患者查头颅MRI提示右侧桥小脑角区脑膜瘤术后,考虑脑膜瘤复发、侵袭可能(图3)。行颅底肿瘤切除,术中肿瘤广泛侵犯乳突骨皮质、硬膜及小脑,延颅底骨质侵犯至颈静脉孔及破裂孔,包绕颈内动脉,肿瘤灰红色,质地韧,血供极其丰富。 术后送检病理,灰白灰红碎组织一堆,总积3×3×1.5cm。组织学:纤维硬化性间质中见多量上皮样小圆细胞浸润,局部间质黏液变(图4),缺乏常见脑膜瘤的形态。免疫组化:MUC-4(弥漫+),CD99(+),Vimentin(+),Fli-1(+),EMA(小灶+),SSTR2(小灶+),PR(-),Desmin(-),CK(pan)(少量+),Syn(灶+),GATA-3(灶+),Ki-67(+3%),,H3K27Me3(+),INI-1(+),CAM5.2(-),PAX-8(-),SOX-10(-),S-100(-),CD31(-),CD34(-),CK5/6(-),GFAP(-),Olig2(-),Calponin(-),SMA(-),STAT6(-),SATB2(-),NKX2.2(-),CD138(-),Wilms Tumor(-)。病理诊断:考虑颅内软组织肿瘤,倾向1.低级别纤维黏液样肉瘤;2.FET-CREB融合阳性的颅内间叶性肿瘤,建议做二代测序分子检测明确。 患者样本通过阔然基因脑膜瘤分子分型检测和融合基因检测项目检测。结果显示,患者肿瘤组织检测出22q缺失、1p、14q缺失(图3)和AP3S2-RWDD2B融合(尚未见文献报道);未检出低级别纤维黏液样肉瘤特异性FUS-CREB3L2融合和颅内间叶性肿瘤FET-CREB家族相关性融合。 根据分子检测结果,患者被确诊为脑膜瘤,分子分型是MC int-A型,同时检出1p/14q染色体缺失,与不良预后和复发风险增加相关,辅助临床解释为何该患者短期复发。 讨论 脑膜瘤是成人最常见的原发性颅内肿瘤,大部分为良性,约20%病例具有侵袭性。组织学分型和分级具有局限性,不能准确反映脑膜瘤的临床预后,因此第5版WHO分类将分子遗传学特征纳入脑膜瘤分类体系中。基于分子检测在脑膜瘤中的研究和应用,阔然基因开发了两款脑膜瘤套餐:脑膜瘤分型用药:针对脑膜瘤相关的基因和部分染色体进行检测,涵盖了脑膜瘤分子分型相关基因、脑肿瘤相关遗传相关基因以及潜在靶向用药相关基因。为脑膜瘤患者的分子分型、靶向用药、预后评估、遗传风险评估及脑胶质瘤发生发展机制提供参考信息,辅助医生制定个体化治疗方案,展示肿瘤突变图谱,促进临床科学研究。 脑膜瘤分子分型检测:利用杂交捕获的方法获得目的基因,并运用二代测序技术检测与脑膜瘤分子分型高度相关的基因的外显子和部分启动子区域。检测信息不仅包括指南推荐与脑膜瘤预后相关基因的变异(点突变、插入、缺失、拷贝数变异)信息,同时还包括了部分染色体变异,为脑膜瘤患者的分子分型、靶向和化疗收益分析、预后评估及脑膜瘤发生发展机制提供参考信息,辅助医生制定个体化治疗方案,展示肿瘤突变图谱,促进临床科学研究和应用。 作者简介 宁波市临床病理诊断中心 主任医师/硕士生导师宁波市临床病理诊断中心神经专科带头人宁波市领军拔尖人才培养对象宁波市卫生健康青年技术骨干人才宁波市医学会外科分会委员,宁波市抗癌协会委员长期从事病理学的医、教、研工作,擅长胶质瘤和脑膜瘤等神经系统疾病的诊断和研究主持和参与省市级科研项目5项,获得专利2项,以第一作者或通信作者发表学术论文30余篇,其中SCI论文7篇
【会议报道】阔然基因助力脑膜瘤分子诊疗专家共识(2022)英文版-发布会圆满召开
由中华医学会神经外科分会神经肿瘤学组,复旦大学附属华山医院神经外科,中华医学杂志英文版共同主办,阔然生物医药科技(上海)有限公司协办的脑膜瘤分子诊疗专家共识(2022)英文版--线下发布会于2月16日在中华医学会神经外科学分会第二十次学术会议期间圆满召开。 2021年5月初,在国家神经疾病医学中心、复旦大学附属华山医院周良辅院士、毛颖院长的指导下,由华山医院的宫晔教授和钟平教授发起、启动了这部共识的筹备工作。历时一年多,召开共识编写项目线上启动会、修订会和定稿会。历经制定标准、文献调研、临床问题构建、确定共识框架、撰写和讨论修改文稿、评分投票、修稿审定等环节,最终全部编写完成。
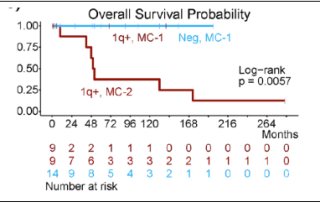
1q染色体拷贝数扩增和甲基化分型在弥漫性软脑膜胶质神经元肿瘤中的预后意义
弥漫性软脑膜胶质神经元肿瘤(DLGNT)是一类胶质神经元肿瘤,弥漫性累及软脑膜,由少突胶质细胞样细胞组成,分子特征为1p染色体拷贝数缺失、1p/19q共缺失和MAPK信号通路基因改变(KIAA1549-BRAF融合最常见)。总体预后良好,现有研究通过甲基化数据将DLGNT肿瘤分为MC-1和MC-2亚型,其中MC-1亚型预后较好。其中在35%的MC-1亚型和所有的MC-2亚型中都存在1q染色体拷贝数扩增,1q拷贝数缺失是预后不良指标。但对于两个不同预后指标之间相关性及协同性目前暂时没有相关研究。 本文收集32例样本进行进一步分析,其中所有样本都具有1p拷贝数缺失,81.3%(26/32)样本中出现KIAA1549-BRAF融合,部分样本存在NTRK或者RAF1基因融合。56.3%(18/32)样本中出现1q染色体拷贝数扩增。1q拷贝数变异通过FISH平台和850k甲基化芯片两个平台进行检测,一致性达到100%。除了1p和1q染色体拷贝数变异外,样本中没有出现大片段的CNV拷贝数变异。 从队列中的PFS结果分析证实1q染色体拷贝数缺失与预后差相关,这个相关性与甲基化分型无关。通过对其进行进一步的多变量Cox回归分析也进一步证明这一结论,且发现与没有发生1q拷贝数缺失的样本相比,发生缺失的样本出现进展的可能性高出约20倍。 OS结果分析显示MC-2肿瘤(均存在1q拷贝数扩增)的生存率低于MC-1肿瘤(存在/不存在1q拷贝数扩增)。由于死亡患者仅存在在MC-2亚型中,因此没有进行多变量Cox回归分析。MC-2亚型的中位死亡时间为51个月(平均99.1个月,范围10-173个月),符合WHO 3级的结果。没有发生1q拷贝数扩增的DLGNT显示出符合WHO 1级的结果。但还需要对1q拷贝数扩增的MC-1亚型患者进行更长时间的随访以及确定1q拷贝数扩增的MC-1亚型和MC-2亚型患者的生存期是否存在明显差异。 本文通过对32例样本数据进行分析证实1q拷贝数扩增是弥漫性软脑膜胶质神经元肿瘤(DLGNT)PFS的预后因素。但仍然需要对1q拷贝数扩增的MC-1亚型进行充分的随访,以确定其生存结果。 作者简介 江南大学附属中心医院神经外科主治医师江南大学无锡医学院神经医学研究中心2022-09-至今,南京医科大学,神经外科学,博士后2019-09至2022-06,南京医科大学,外科学(神经外科),博士2016-09至2019-06,南京医科大学,外科学(神经外科),硕士2011-09至2016-06,南京医科大学,临床医学,学士
颅外转移性脑膜瘤及其原发病灶的分子突变特征
脑膜瘤是最常见的中枢神经系统肿瘤,起源于软脑膜蛛网膜帽细胞[1]。绝大多数脑膜瘤是WHO 1级肿瘤,手术切除后远期疗效良好。大多数患者存在局限性疾病,手术切除的程度是与肿瘤分级无关的长期肿瘤控制和总体生存的较强临床预后因素。然而,脑膜瘤颅外转移是罕见的,仅发生在不到1%的脑膜瘤中,越高级别的脑膜瘤转移的可能性越高[2]。 目前DNA甲基化分析、基因表达特征、拷贝数改变和组织形态特征常被用来更准确地预测脑膜瘤的长期复发与进展。许多基因突变与颅内脑膜瘤的发生发展密切相关,其中最常见的是NF2(Moesin-Ezrin-Radiin like(Merlin)肿瘤抑制因子)的失活,其次是TRAF7和KLF4的突变。NF2基因位于22号染色体上,具有肿瘤抑制基因的功能。在大约40-60%的散发性脑膜瘤和80%的高级别脑膜瘤中,NF2的失活是肿瘤发生和发展的原因[3],文献表明TRAF7和KLF4基因突变则与更良性的临床病程相关[4]。在非NF2突变的侵袭性脑膜瘤组中,大约5%的肿瘤出现染色质调节因子BAP1和PBRM1的改变,并与更具侵袭性的临床行为相关[5]。另外,TERT启动子突变和CDKN2A/B纯合缺失同样与更具侵袭性的脑膜瘤有关。目前,越来越多的脑膜瘤临床指南将分子突变特征纳入其中,越来越多的文献表明CDKN2A/B纯合缺失、TERT启动子突变或BAP1的改变与脑膜瘤更具侵袭性的临床病程关系密切[6]。然而,由于转移性脑膜瘤的发病率较低,我们对转移性脑膜瘤的遗传特征及其相关的临床行为知之甚少。 最近的一篇研究对5例颅外转移性脑膜瘤及其原发肿瘤的临床及分子突变特征进行了分析[7]。分子突变分析图谱显示,在这5名患者中有4名患者的颅外转移性脑膜瘤与原发病灶出现了相同或重叠的基因突变,这证实了颅外病灶是颅内转移而来,另1名患者的颅内和颅外病灶出现了不同的基因突变,因此被认为是各自独立的肿瘤并在后续的分析中被排除。在对这4名颅外转移性脑膜瘤的基因图谱分子中发现,其中3名患者的原发颅内病灶和颅外转移肿瘤均包含BAP1基因突变,另1名患者被诊断患有BAP1肿瘤易感综合征。BAP1突变方式主要包括移码突变、过早终止突变和拷贝数改变,并且BAP1突变WHO 1-3级中均有分布(表1)。 BAP1抑癌基因在DNA修复机制、转录、细胞死亡和线粒体代谢在内的各种过程中发挥着关键作用[8]。Shankar et al.[9]发现与BAP1缺乏的横纹肌样脑膜瘤患者相比,散发性或家族性BAP1突变的横纹肌样脑膜瘤患者的临床病程更具侵袭性。BAP1基因突变在乳头状脑膜瘤中也会偶尔出现。然而,到目前为止,还没有临床研究将BAP1突变的脑膜瘤与远处颅外转移联系起来。对肿瘤原发灶和转移灶之间的分子图谱的比较为许多癌症的研究提供了很大的帮助。然而,到目前为止,我们对颅外转移性脑膜瘤及原发病灶的了解知之甚少。 目前关于颅外转移性脑膜瘤的研究较少,来自其他恶性肿瘤的分子研究表明肿瘤由具有独特基因组变化的多个克隆组成,这些细胞化合物在发展或被治疗过程中可能会改变它们的基因组特征。转移性病变通常来自原发肿瘤的克隆亚群,并含有额外的突变。既往有研究报道了葡萄膜黑色素瘤中携带BAP1突变的患者有转移的风险[10,11],这表明脑膜瘤患者也有类似的风险。BAP1基因突变与脑膜瘤的颅外转移可能密切相关,其潜在的致病机制有待进一步研究。 目前对脑侵袭性脑膜瘤的定义缺乏统一的标准,导致脑侵袭性脑膜瘤在不同文献中的发生率差异较大(5%-78%),随脑膜瘤级别而升高,3级脑膜瘤可达70%-100%[9]。目前采用得最多的定义如图2 A和B所示,脑膜瘤呈指状或结节状的突入脑组织中,且脑膜瘤和脑组织之间缺乏软脑膜结构。但是也有研究认为如C图所示,这样单个脑膜瘤细胞进入脑组织也属于脑侵袭,甚至还有文章认为,脑膜瘤侵入脑血管周围间隙也属于脑侵袭,这就造成了对脑侵袭性脑膜瘤本身的诊断标准差异较大。但是对于一些与脑侵袭相关的临床因素,目前普遍认为瘤周水肿体积是与脑侵袭独立相关因素,并在影像组学中得到了验证[10]。此外,术中取材也可能对术后病理诊断脑侵袭产生影响,例如2020年,Felix Behling等人回顾性分析了1741例脑膜瘤患者,将手术记录中“肿瘤侵袭性生长”或“软脑膜-蛛网膜结构破坏”作为术中诊断脑侵袭的标准,再与病理结果进行对比,结果发现23.7%的脑膜瘤在术中发现有脑侵袭,而在术后病理结果中仅为4.8%,但两者均可预测预后[11]。对于两者之间存在明显差异的原因,研究人员认为可能来源于样本取材不一致,即除非获得完整的肿瘤-皮质界面以明确脑侵袭,否则会漏诊脑侵袭性脑膜瘤。 参考文献 [1]Ostrom QT, Patil N, Cioffi G, Waite K, Kruchko C, Barnholtz-Sloan JS (2020) CBTRUS statistical report: primary brain and other central nervous system tumors diagnosed in the United States in 2013–2017. Neuro Oncol 22: iv1– iv96.[2]Dalle Ore CL, Magill ST, Yen AJ, Shahin MN, Lee DS, Lucas CG, Chen WC, Viner JA, Aghi MK,